
Иллюстрация Макколл Сарретт
Будь то забывание 20 лет вашей жизни или раз в пять минут один и тот же разговор только для того, чтобы забыть об этом каждый раз, ухудшение памяти может серьезно сказаться на повседневной жизни. Это может быть одним из самых запутанных аспектов нейродегенерации и является ключевым симптомом деменции.
Болезнь Альцгеймера, также известная как AD, является наиболее распространенной формой деменции, характеризующейся когнитивными трудностями и потерей памяти. В настоящее время не существует официальной клинической методики диагностики АД, кроме вскрытия. Тем не менее, есть две характерные особенности ткани мозга пациентов с болезнью Альцгеймера: амилоидная бета (А?) бляшки и нейрофибриллярные сплетения, оба из которых обеспечили значительное понимание патологии нейродегенерации.
«Нейрофибриллярные клубки возникают из-за дефекта белков, называемых тау-белками».
А? представляет собой белок, образующийся в результате расщепление белков of Амилоидный белок-предшественник (APP). Это означает, что APP разрезается на более мелкие фрагменты, одним из которых является A? фрагмент. АРР разрезается на эти части ферментами, называемыми секретазами, основная роль которых заключается в расщеплении этих белков. Существуют различные секретазы, но есть одна, значимая для патологии Альцгеймера – гамма-секретаза. Гамма-секретаза производит особую форму A?: A?-42, наиболее токсичную форму белка. После распада эти фрагменты белка начинают собираться в пространстве вне клеток. Ключом к токсичности этих белков является то, что они обладают характерной «липкостью», поэтому начинают образовывать агрегаты. Эти агрегаты продолжают развиваться, и вскоре эти бляшки бета-амилоида появляются повсюду, сильно нарушая функцию нейронов.
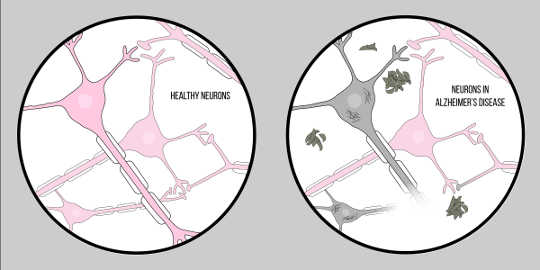 Рисунок Макколл Сарретт
Рисунок Макколл Сарретт
Это влияние А? на неврологические функции привело к Амилоидная гипотезаХорошо известная теория, предлагающая объяснение нейродегенерации при болезни Альцгеймера.
Теперь для второй ключевой характеристики: нейрофибриллярные клубки. Нейрофибриллярные клубки возникают из-за дефекта белков, называемых тау-белками. Белки тау служат мостом между структурами, называемыми микротрубочками внутри клетки. Микротрубочки являются поддерживающими молекулами, которые обеспечивают форму и структуру клеток, в частности, аксонов. Белки тау помогают этим микротрубочкам обеспечить структуру аксонов. Тем не менее, в случае Болезнь АльцгеймераНейродегенеративное заболевание, характеризующееся потерей нейронов i ..., тау-белки отделяются и накапливаются в клеточном теле, иначе известном как сома. Это вызывает дегенерацию аксонов, что еще более затрудняет общение нейронов. Эта трудность в нейрональном общении схожа с эффектами бета-амилоида; однако важно отметить, что эти клубки сильно отличаются от бляшек, обсуждавшихся ранее, тем, что они влияют на связь внутри клетки, а не снаружи.
«Ученые до сих пор не уверены в точном механизме, ответственном за патологию болезни Альцгеймера».
Хотя оба чрезвычайно влиятельны, А? и тау — не единственные важные факторы, когда речь идет о патологии болезни Альцгеймера. Исследования показали, что аполипопротеин E (APOE) ген может быть столь же влиятельным, как A?. Существует три основных варианта, кодирующих белки: ApoE2, ApoE3 и ApoE4. Было показано, что ApoE4 коррелирует с уменьшением синаптической обрезки, тогда как ApoE2 приводит к увеличению. Обе формы влияют астроциты (важный глиальные клетки внутри нервной системы) и соотносятся с их скоростью фагоцитоза, процессом, с помощью которого астроцитыЗвездообразные глиальные клетки, которые выполняют ряд функций, охватывают клеточный материал. Каждый вариант ApoE напрямую влияет на эту скорость фагоцитоза, ApoE2, что приводит к увеличению, и ApoE4, уменьшение. Это говорит о том, что астроциты могут быть менее способны «убирать» осколки, плавающие в клетке, когда коррелируют с ApoE4. Таким образом, когда эти бляшки накапливаются, генотип ApoE4 может предотвращать клиренс этих агрегатов, способствуя дегенерации.
Бета-амилоид, тау и различные гены работают вместе, вызывая серьезную проблему связи между клетками, которая по сути является болезнью, которую мы знаем как болезнь Альцгеймера. Такая нейродегенерация наиболее распространена в областях мозга, связанных с обучением и памятью, но в конечном итоге распространяется по всему мозгу. С этим недостатком общения происходит потеря синапсов и, в конечном итоге, уменьшение мозговой материи. Таким образом, нормально видеть уменьшение мозговой ткани на МРТМагнитно-резонансная томография, техника для наблюдения за структурой по мере прогрессирования заболевания, показывает, что болезнь Альцгеймера буквально сокращает мозг. Наши современные модели обучения и состояния памяти, которые синапсы играют ключевую роль в этих процессах, обеспечивая возможное объяснение того, как эта патология соотносится с основными симптомами AD, такими как потеря памяти.
Ученые до сих пор не уверены в точном механизме, ответственном за патологию болезни Альцгеймера. Многие инновационные методы были исследованы в попытке получить дополнительные знания об этой патологической точке, один из которых - биомаркеры спинномозговой жидкости (CSF).
Уровни А? а тау можно измерить в спинномозговой жидкости с помощью процедуры, называемой люмбальной пункцией, при которой собирают спинномозговую жидкость. Повышенный уровень тау и сниженный уровень А? наблюдаются у пациентов с болезнью Альцгеймера. Это результат А? накопления в мозге, что, в свою очередь, приводит к снижению концентрации в спинномозговой жидкости. Эти данные позволяют предположить, что в будущем врачи и ученые смогут предсказывать когнитивное состояние пациента, исследуя уровень белка в спинномозговой жидкости.
В настоящее время нет окончательного лечения болезни Альцгеймера. Тем не менее, растущее знание патологических белков, связанных генов и текущих научных исследований дает надежду на эффективное лечение в будущем.
Какой прорыв, по вашему мнению, нужен медицине для лечения болезни Альцгеймера? Дайте нам знать об этом в комментариях!
Эта статья первоначально появилась на Зная нейроны?
Об авторе
Хайла Блэк - новичок в нью-йоркском университете в Шанхае, который планирует объявить специализацию в области нейронных наук, а в области наук о данных - специализацию с искусственным интеллектом. В будущем она надеется получить степень доктора медицины и доктора наук и стать нейробиологом, изучающим молекулярные аспекты обучения и памяти. В свободное время Хайла с удовольствием работает с инициативой MYELIN в рамках IYNA, а также читает любые материалы, связанные с нейронаукой. Помимо изучения неврологии, она любит бегать, преподавать в местных начальных школах, решать математические задачи и пить огромное количество кофе.
Книги по этой теме
at Внутренний рынок самовыражения и Amazon
Рекомендации
Лакор, П.Н., Буниел, М.К., Ферлоу, П.В., Клементе, А.С., Веласко, П.Т., Вуд, М., . . . Кляйн, В.Л. (2007 января 24 г.). А? Вызванные олигомерами аберрации в Synapse Состав, форма и плотность обеспечивают молекулярную основу для потери связи при болезни Альцгеймера. Полученное из http://www.jneurosci.org/content/27/4/796
Мерфи, член парламента, и ЛеВин, Х. (2010). Болезнь Альцгеймера и β-амилоидный пептид. Журнал болезни Альцгеймера?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
О'Брайен, Р.Дж., и Вонг, ПК (2011). Обработка белка-предшественника амилоида и болезнь Альцгеймера. Ежегодный обзор неврологии, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD, ... Barres, BA (2016). Новая аллель-зависимая роль APOE в контроле скорости синапсСвязи между нейронами, откуда сигнал передается на ... обрезку астроцитами. Труды Национальной академии наук Соединенных Штатов Америки, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Зеттерберг, Х. (2009 августа 19 г.). Амилоид? и APP как биомаркеры болезни Альцгеймера. Извлекаются из https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























